La tiroidite di Hashimoto a lenta progressione (a volte gozzigena) è più spesso associata agli alleli HLA-DR5 e HLA-DR3, ma con una distribuzione variabile a seconda della popolazione.5 La forma atrofica rapida mostra una più forte associazione con HLA-DR3 e HLA-DR15 (DR2). In alcuni studi, anche HLA-B8 risulta più frequente.6
Altri geni immunoregolatori
Nella tiroidite atrofica è stata osservata una maggiore frequenza di polimorfismi nei geni che regolano la risposta T-helper:
- CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4): varianti alleliche che riducono la tolleranza immunitaria sono più rappresentate e aumentano la predisposizione alla forma atrofica.7
- PTPN22 (Protein tyrosine phosphatase non-receptor type 22): polimorfismo 1858C>T associato a maggiore rischio di autoimmunità sistemica, compresa la tiroidite atrofica.8
Nella forma lenta queste varianti possono essere presenti, ma con un impatto meno marcato sull’aggressività immunologica.
Risposta autoimmune differente:
nella forma atrofica rapida prevale la risposta cellulo-mediata Th1 (linfociti T citotossici con distruzione follicolare precoce ad evoluzione fibrotica). Nella forma a lenta progressività, invece, è più marcata la risposta autoanticorpale Th2 (anti-TPO, anti-Tg) e la risposta umorale, con distruzione progressiva con, a volte, tendenza a formare gozzo.3-5
Tabella 1 Sintesi delle differenze genetico-immunologiche
| Caratteristica | Hashimoto a lenta evoluzione | Hashimoto a rapida evoluzione atrofica |
|---|---|---|
| HLA più associati | DR5, DR3 | DR3, DR15, B8 |
| Autoanticorpi | Anti-TPO/Anti-Tg molto elevati | Possono essere più bassi o assenti |
| Geni regolatori | CTLA-4 (variabile) | CTLA-4, PTPN22 più frequentemente patologici |
| Risposta immunitaria | Prevalenza umorale (anticorpi) riposta Th2 | Prevalenza cellulo-mediata (linfociti Th1) |
| Decorso | Lento, a volte con ipertrofia ghiandolare | Rapida atrofia, ipotiroidismo precoce |
In sintesi, la differenza genetica tra le due forme non è data da un singolo gene, ma da combinazioni di alleli HLA e polimorfismi in geni regolatori dell’immunità.
Nella forma atrofica rapida il peso genetico sembra orientare verso una risposta T-cellulare più aggressiva, mentre nella forma lenta domina la produzione anticorpale, con progressione più graduale. La Tabella 2 riassume le principali differenze genetiche tra le due forme di tiroidite di Hashimoto: quella rapidamente atrofica e quella a lenta progressione.
Tabella 2 Differenze genetiche e immunologiche
| Caratteristica | Hashimoto a lenta evouzione | Hashimoto a rapida evoluzione atrofica |
|---|---|---|
| HLA (Complesso Maggiore di Istocompatibilità - MHC II) | Associata soprattutto agli alleli HLA DR5 | Associata al più forte con HLA-DR3 |
| Geni immuno-regolatori (non-MHC) | Presenza di polimorfismi, ma meno marcatamente distinti tra le forme | CTLA-4: polimorfismi frequenti, ridotta tolleranza immunologica; PTPN22: variante associata a risposta autoimmune aggressiva |
| Altri geni associati | Coinvolti: FCRL3, FOXE1, IL2RA, ZFAT, thyroglobulina (TG), microRNA (es. miR499A, miR125A) | Coinvolti anch’essi, ma meno differenziati tra i fenotipi |
| Impatto immunologico | Dominanza della risposta umorale (anticorpi anti-TPO, anti-Tg), possibile sviluppo progressivo del gozzo e/o resistenza alla regressione volumetrica ghiandolare nel tempo | Risposta prevalentemente cellulomediata (linfociti T citotossici) con distruzione follicolare e fibrosi rapida |
Inoltre, la forma gozzigena è associata ad HLA DR5, mentre la forma atrofica lo è ad HLA DR3. Nella tiroidite atrofica, i polimorfismi nel gene CTLA 4 (che hanno un ruolo centrale nell’immunotolleranza) e nel gene PTPN22 (noto fattore di suscettibilità per molte malattie autoimmuni) sono più frequentemente coinvolti e contribuiscono alla suscettibilità generale. In entrambe le forme di Hashimoto, altri geni implicati includono FCRL3, FOXE1, IL2RA, TG, ZFAT e persino microRNA (come miR499A e miR125A), ma non sono specifici per l’una o l’altra forma. La differente direzione della risposta immunitaria (anticorpale nella forma lenta e cellulomediata in quella atrofica) contribuisce al diverso decorso clinico. Nella tiroidite di Hashimoto (TH), compresa la forma atrofica e quella a lenta progressività, il profilo citochinico è stato studiato soprattutto in relazione allo shift immunitario verso Th1 e, in minor misura, verso Th17, con riduzione relativa della risposta Th2. Le interleuchine coinvolte possono variare a seconda della fase e del fenotipo clinico. 5,7,8 e 21-24
Tiroidite di Hashimoto variante atrofica
Prevalenza di citochine Th1 e Th17:- IL-2 e IL-12: attivano e mantengono la risposta Th1.
- IFN-γ (non è un’interleuchina, ma è importante): amplifica il danno autoimmune e l’espressione di HLA-II sugli epiteli tiroidei.
- IL-17: promuove infiammazione cronica e fibrosi, più tipica delle forme atrofiche.
- IL-1β e TNF-α (di derivazione macrofagica): sinergizzano nella distruzione follicolare.
- IL-10: può essere presente, ma spesso con attività insufficiente a controbilanciare l’infiammazione.
Tiroidite di Hashimoto a lenta progressività
La Tiroidite di Hashimoto a lenta progressività presente un profilo simile, ma con meno marcata espressione Th1/Th17 e una maggiore influenza Th2/Treg (Figura 1) :
- IL-4 e IL-10sono più rappresentate rispetto alla forma atrofica, ma mantengono una risposta più regolata.
- IL-6 è presente come mediatore di infiammazione cronica, ma meno aggressiva.
- IL-2 e IL-12 ancora rilevanti, ma a livelli inferiori rispetto alla variante atrofica. Questo si traduce in una progressione più lenta verso l’ipotiroidismo clinico, con tessuto tiroideo che resiste più a lungo alla distruzione.
- Equilibrio citochinico più modulato con presenza di IL-4, IL-6, IL-10, con minore aggressività infiammatoria. 12-15
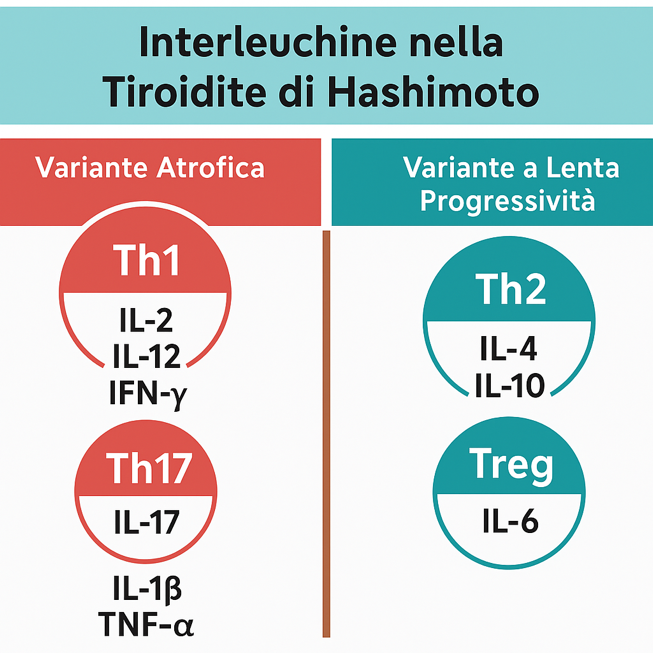
Tabella 3 Confronto delle interleuchine più rilevanti nelle due varianti della tiroidite di Hashimoto
| Interleuchina / Citochina | Variante Atrofica | Variante a Lenta Progressività |
|---|---|---|
| IL-2 | ↑ Elevata, stimola linfociti T autoreattivi (Th1) | Presente ma meno marcata |
| IL-12 | ↑ Aumentata, promuove risposta Th1 | Moderata |
| IL-17 | ↑↑ Forte presenza (risposta Th17, fibrosi e distruzione) | Bassa o moderata |
| IL-1β | ↑ Contribuisce a infiammazione e apoptosi tireociti | Bassa |
| TNF-α | ↑↑ Importante per il danno follicolare e la fibrosi | Meno rilevante |
| IFN-γ (non IL, ma cruciale) | ↑↑ Rafforza risposta Th1 e espressione HLA-II | Presente ma meno dominante |
| IL-4 | ↓ Ridotta (debole risposta Th2) | ↑ Maggiore, contribuisce a rallentare la distruzione |
| IL-6 | Moderata, legata a infiammazione cronica | ↑ Presente, associata a lenta progressione |
| IL-10 | Bassa, insufficiente a bloccare l’autoimmunità | ↑ Maggiore, con effetto regolatorio parziale |
Profilo istologico
La tiroidite cronica atrofica (forma “fibrosa” o “burned-out”) presenta (Tabella 4):
- Aspetto generale: ghiandola ridotta di volume, con marcata fibrosi e sostituzione del parenchima. 3,4
- Infiltrato linfocitario: spesso meno intenso rispetto alla fase attiva di Hashimoto; prevale la fibrosi interstiziale. 3
- Follicoli tiroidei: molto ridotti, talvolta assenti o sostituiti da tessuto fibroso. 4,16
- Cellule ossifile (Hürthle o Askanazy): poco rappresentate o assenti, perché il parenchima follicolare è ormai distrutto. 16
- Caratteristica chiave: atrofia marcata dei follicoli con sclerosi diffusa e quadro di “ghiandola cicatriziale”. 3,4
La tiroidite cronica a lenta progressività (“slow-burning”) presenta (Tabella 4):
- Aspetto generale: ghiandola di solito aumentata di volume (gozzo), consistenza dura ma non fibrotica in modo massivo. 3,4
- Infiltrato linfocitario: abbondante, con organizzazione in centri germinativi linfoidi (aspetto linfonodo-like). 3,16
- Follicoli tiroidei: presenti ma progressivamente distrutti; si osserva metaplasia ossifila delle cellule follicolari (cellule di Hürthle). 16
- Cellule ossifile: abbondanti, tipiche della fase attiva della malattia. 4,16
- Fibrosi: di grado variabile ma meno marcata rispetto alla forma atrofica; non sostituisce completamente il parenchima. 3,4,17
Tabella 4 Confronto tra tiroidite atrofica e tiroidite cronica a lenta progressività (Hashimoto classica)
| Caratteristica istologica | Tiroidite atrofica | Tiroidite a lenta progressività (Hashimoto classica) |
|---|---|---|
| Volume ghiandolare | Ridotto (ghiandola piccola, fibrotica) | Aumentato (gozzo duro, elastico) |
| Infiltrato linfocitario | Presente, ma meno intenso | Abbondante, con centri germinativi |
| Follicoli tiroidei | Atrofici o assenti, sostituiti da fibrosi | Presenti ma progressivamente distrutti |
| Cellule ossifile (Hürthle/Askanazy) | Rare o assenti | Numerose, metaplasia ossifila tipica |
| TNF-α | ↑↑ Importante per il danno follicolare e la fibrosi | Meno rilevante |
| Fibrosi | Diffusa e marcata, sostituisce il parenchima | Presente ma moderata, non massiva |
| Aspetto finale | “Ghiandola cicatriziale” | “Aspetto linfonodo-like” (per infiltrato con centri germinativi) |
Conclusione
La tiroidite di Hashimoto può seguire due principali evoluzioni con differenti implicazioni oncologiche. Nelle forme a lenta evoluzione (“slow-burning”), caratterizzate da voluminoso infiltrato linfocitario, formazione di centri germinativi, nodularità e persistenza dell’attività tireotropinica, si determina un microambiente pro-infiammatorio(aumento stress ossidativo con aumento dei radicali liberi, frammentazione del DNA, mutazioni somatiche etc) favorevole alla trasformazione neoplastica.
In questo contesto risulta aumentato il rischio di carcinoma papillifero della tiroide (PTC), oltre che di linfoma tiroideo primitivo, soprattutto di tipo MALT, come confermato da studi epidemiologici.
Al contrario, le forme atrofiche a rapida evoluzione (“burned-out”), contraddistinte da fibrosi diffusa, riduzione volumetrica e distruzione precoce del parenchima follicolare, presentano un rischio oncologico sensibilmente minore. La perdita del substrato linfoide e l’assenza di nodularità rendono infatti molto meno probabile lo sviluppo di neoplasie, sia differenziate che linfoidi. Queste osservazioni, pur fondate su dati epidemiologici consistenti e su una plausibile interpretazione biologica, non derivano da confronti prospettici diretti fra i due fenotipi. È quindi auspicabile che studi futuri chiariscano e quantifichino con maggiore precisione il diverso profilo di rischio oncologico, così da integrare questa distinzione clinico-patologica nella pratica di stratificazione e follow-up dei pazienti con tiroidite di Hashimoto. 16-20