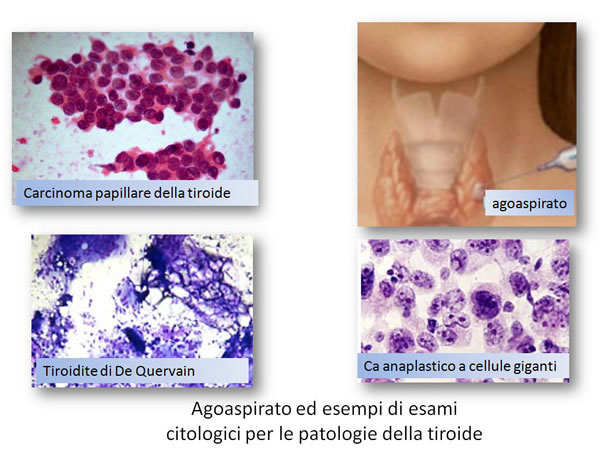
La citologia su agoaspirato (FNAB: “fine-needle ago- biopsy”), effettuata con ago sottile, in mani esperte, rappresenta la migliore metodica per la diagnosi di natura delle lesioni nodulari della tiroide.
Nonostante si tratti di una metodica caratterizzata da elevata sensibilità, ha due limiti:
i campionamenti "inadeguati" e le diagnosi "indeterminate" (diagnosi differenziale fra neoplasie follicolari benigne(iperplasia e adenoma follicolare) e maligne fra cui la variante follicolare del PTC).
Per evitare e ridurre il numero di campionamenti non idonei, l'agoaspirato deve essere
- eco-guidato, piuttosto che "a mano libera"; ciò permette di selezionare i noduli da esaminare in un contesto plurinodulare; di mirare il prelievo nel singolo nodulo (per esempio la porzione solida di un nodulo parzialmente cistico); di ridurre il rischio di complicanze per danno da puntura accidentale di vasi, nervi e trachea.
- la lettura dei preparati deve essere effettuata da un patologo esperto.
La selezione dei noduli da agoaspirare è affidata all'ecografia in base, a criteri morfologici e dimensionali, ma anche, più recentemente al pattern elastosonografico e colorpowerdoppler.
Sono candidati alla FNAB i noduli che presentano caratteristiche sospette all’ecografia: ipoecogenicità, margini irregolari, microcalcificazioni, assenza di alone ipoecogeno periferico, aspetto "taller than wide", vascolarizzazione intranodulare, e pattern elastosonografico 3 - 4.
L'associazione di nodulo ipoecogeno ad una o più caratteristiche morfologiche aumenta il rischio di malignità
Per quanto riguarda i criteri dimensionali, le più recenti linee guida internazionali non raccomandano l'esame citologico sui noduli di dimensioni < l cm, indipendentemente dalle caratteristiche ecografiche. Fanno eccezione quei casi in cui ci sia evidenza ecografica di estensione extratiroidea del nodulo o di linfonodi sospetti loco-regionali
L'elastografia, tecnica di imaging introdotta di recente, rileva il grado di "elasticità" del nodulo ed in base a questa caratteristica, è in grado di stimare il rischio di malignità. Tuttavia, necessita di ampi studi prospettici per verificarne l'utilità clinica. Analoga considerazione è per I'Impiego dei mezzi di contrasto ecografici.
CLASSIFICAZIONI CITOLOGICHE
Negli ultimi anni le descrizioni e le terminologie citologiche si sono uniformate in modo da permettere al patologo ed all’endocrinologo di interagire più efficacemente fra loro a garanzia di una migliore selezione dei soggetti da avviare al trattamento chirurgico.
I sistemi classificativi più utilizzati sono basati su schemi a 5 oppure 6 categorie: nel 2014 è stata aggiornata la classificazione Italiana, mantenendo lo schema a 5 categorie [associate al suggerimento di un comportamento clinico in relazione al rischio atteso di malignità, con importanti variazioni relativamente alla categoria TIRI e TIR3, e rendendola confrontabile con le altre principali classificazioni utilizzate: quella Americana (Bethesda System) e quella Inglese (UKRCP)].
CLASSIFICAZIONE ITALIANA DELLA CITOLOGIA TIROIDEA
Codice |
Categoria diagnostica |
Rischio atteso di malignità % |
Suggerimento clinico |
TIRI |
Non diagnostico |
Non definito |
Ripetizione di FNA US dopo almeno un mese |
TIRI C |
Non diagnostico, cistico |
Basso, variabile in base al quadro clinico |
Secondo il contesto clinico e/o ripetere FNA |
TIR2 |
Non maligno / benigno |
|
Follow — up |
TIR3 A |
Lesione indeterminata a basso rischio |
< 10 |
Follow — up / ripetere FNA |
TIR3 B |
Lesione indeterminata ad alto rischio |
15 30 |
Exeresi chirurgica |
TIR4 |
Sospetto di malignità |
60 80 |
Exeresi chirurgica / eventuale istologia intraoperatoria |
TIR5 |
Maligno |
95 |
Exeresi chirurgica; approfondimento diagnostico in casi selezionati |
CONFRONTO TRA LA CLASSIFICAZIONE CITOLOGICA ITALIANA ,AMERICANA ED INGLESE
ITALIA: SIAPEC-IAP, AIT, AME, SIE |
USA: Bethesda |
UK: RCPath |
TIRI. Non diagnostico
TIRI C. Non diagnostico cistico |
I. non diagnostico. Cistico. |
Thy 1 / Thy 1c. Non diagnostico. Cistico |
TIR2. Non maligno |
11. Benigno |
Thy 2 / Thy 2c. Non neoplastico |
TIR3 A. Lesione indeterminata a basso fischio |
III. Atipie di significato indeterminato o lesione follicolare
AUS / FLUS * |
Thy 3a. Possibile neoplasia atipia / non diagnostico |
TIR3 B. Lesione indeterminata ad alto rischio |
IV. Neoplasia follicolare o sospetta per neoplasia follicolare |
Thy 3f. Possibile neoplasia / suggestivo di neoplasia follicolare |
TIR4. Sospetto di malignità |
V. Sospetto di malignità |
Thy 4. Sospetto di malignità |
TIR5. Maligno |
V1. Maligno |
Thy 5. Maligno |
*AUS (atypia of undetermined significance); FLUS (follicular lesion of undetermined significance)
Nella classificazione Italiana i codici TIR2, TIR4 e TIR5 non sono sostanzialmente differenti rispetto alla classificazione precedente del 2007; sono state invece introdotte modifiche relativamente alle categorie TIRI e TIR3 che comportano anche un aggiornamento dei possibili compionamenti clinici da adottare.
Nella categoria TIR 1, che comprende i campioni cellulari non rappresentativi e/o inadeguati (non dovrebbero superare il 10% dei casi, escluse le lesioni cistiche), viene introdotta la categoria TIR 1C. Quest'ultima è rappresentativa di lesioni parzialmente cistiche con colloide scarsa e cellularità non adeguata che sono generalmente di natura benigna e richiedono la ripetizione dell'agoaspirato solo in presenza di un sospetto clinico (per escludere un PTC cistico). Va inoltre precisato che i campioni scarsamente cellulari che presentino atipie vengono classificati nelle categorie a rischio e non nella TIRI.
La categoria TIR3, che nella precedente classificazione poneva l'indicazione all'intervento chirurgico, è stata suddivisa in due sottoclassi:
- TIR3A che comprende le lesioni indeterminate con basso rischio atteso di malignità (< 10%) per le quali è possibile attuare una sorveglianza clinica che prevede la rivalutazione ecografica ed eventualmente la ripetizione dell'ago aspirato;
- TIR3B che include le lesioni indeterminate ad alto rischio atteso di malignità (15 - 30%) con il suggerimento di provvedere all'exeresi chirurgica.
La suddivisione della categoria TIR3 nelle due sottocategorie A e B ha l'obiettivo di ridurre il numero di soggetti candidati alla chirurgia per patologia benigna.
Va tuttavia precisato che questa sottoclassificazione deriva soprattutto dall'esperienza clinica ed è parzialmente sostenuta da evidenze scientifiche. Per tal motivo la nuova classificazione italiana richiederà di essere validata da uno studio multicentrico e sarà sottoposta a revisione.
In entrambe le categorie citologiche, la decisione terapeutica (sorveglianza vs. lobectomia vs. tiroidectomia totale) va integrata con l'eventuale presenza di fattori di rischio clinici (es., familiarità di I grado per carcinoma tiroideo, esposizione a radiazioni), le caratteristiche ecografiche e le dimensioni del nodulo, il riscontro di noduli tiroidei controlaterali alla lesione oggetto di valutazione citologica, la volontà del paziente.
Il referto TIR 3 rimane sempre un limite della FNAB essendo una tipologia di refertazione “neutral”: neither benignancy nor malignancy” per l’impossibilità del citologo nel differenziare quadri di sicura benignità (iperplasia follicolare e adenoma follicolare ben differenziato) dal carcinoma differenziato della tiroide.
La sub-classificazione in TIR3a e 3b tenta di ridurre al minimo il ricorso alla chirurgia ma richiede il follow-up stretto clinico ecografico e citologico.
La diagnosi citologica TIR4 e TIR5, in assenza di evidenza radiologica di localizzazioni linfonodali, pone l'indicazione all'exeresi chimrgica, o mediante lobectomia o mediante tiroidectomia totale.
La tiroidectomia totale è da preferire per
- noduli con diametro massimo superiore a 4 cm;
- evidenza di estensione extratiroidea della neoplasia;
- evidenza di multifocalità del carcinoma;
- evidenza di metastasi linfonodali del collo;
- presenza di familiarità di primo grado per carcinoma tiroideo;
- storia personale di irradiazione al collo.
BIOLOGIA MOLECOLARE
La citologia su agoaspirato (FNAB) rappresenta l'indagine cardine nella diagnosi di natura del nodulo tiroideo tuttavia soffre il limite delle diagnosi indeterminate o sospette che inducono all'intervento chirurgico per ottenere la conferma istologica.
Considerato che la percentuale attesa di noduli benigni è > del 90% nella categoria citologica TIR3A, tra 70% e 85% nella categoria TIR3B e tra il 20% e il 40% nella categoria TIR4, si è cercato di individuare ulteriori parametri, che fossero predittivi di malignità, da associare alla diagnostica citologica così da migliorarnne la performance diagnostica e ridurre la morbidità e i costi derivanti da interventi di tiroidectomia non necessari e/o per stabilire l'estensione della resezione chirurgica.
Di recente, è stata proposta l'analisi molecolare applicata alla citologia tiroidea a seguito della scoperta delle alterazioni genetiche che sono coinvolte nello sviluppo del carcinoma differenziato della tiroide; in particolare, nel PTC il fianangiamento di recettori trans membrana ad attività tirosin-chinasica (RET/PTC e NTRKI) e le mutazioni attivanti di BRAF e RAS e, nel FTC, il riarrangiamento di PAX8/PPARy e le mutazioni attivanti di RAS.
Sono stati proposti due pannelli di diagnostica molecolare: il primo prevede la valutazione delle più comuni mutazioni riscontrate nei PTC e FTC (RET/PTCI, RET/PTC3, BRAFV600E, HRAS, KRAS, NRAS, PAX8/PPARY), questo pannello è caratterizzato da un elevato valore predittivo positivo (PPV 87 95% nelle lesioni citologicamente indeterminate) ma la relativa elevata percentuale di falsi negativi (32 - 43%) riduce significativamente la sensibilità (57 - 68%) e quindi il valore predittivo negativo (Nikiforov Y, 2011).
Il secondo pannello prende il nome di GEC (Gene Expression Classifier) ed analizza l'espressione di 167 geni nell'RNA estratto dal citoaspirato; questo test si propone di identificare i noduli benigni ed è caratterizzato da un elevato valore predittivo negativo (negative predictive value (NPV) 85-95%) ma col limite di una significativa percentuale di falsi negativi (6 - 18%) (Alexander EK, 2012; Walsh PS, 2012).
Da segnalare che entrambi questi sistemi sono utilizzati al momento solo in centri altamente specializzati degli Stati Uniti e che non sono attualmente disponibili in Europa ed in Italia.
Più diffusa è la ricerca di singole o poche mutazioni nel campione citologico.
Vi sono molti contributi scientifici che hanno valutato la presenza di una mutazione di BRAFV600E nelle citologie indeterminate o non diagnostiche, riscontrandola nel 15 - 39% dei casi con un tasso di malignità pari al 99,8% dei casi. Tale mutazione è tipicamente presente in circa il 45% dei casi di PTC (variante classica e a cellule alte; più raramente nella variante follicolare del PTC) e, meno frequente, nel carcinoma scarsamente differenziato e anaplastico (correlata alla presenza di aree di PTC ben differenziato nel contesto del carcinoma anaplastico) ma non nell'FTC e nei noduli benigni.
La mutazione di BRAFV600 secondo alcuni studi scientifici sarebbe stata associata ad una prognosi meno favorevole correlata alla presenza di metastasi linfonodali, estensione extratiroidea della neoplasia, stadio più avanzato alla diagnosi, riduzione dell'intervallo libero da malattia e del tasso di sopravvivenza.
Altre evidenze scientifiche non confermano questa correlazione, per cui ad oggi la sua utilità clinica risulta limitata (Nikiforov YE, 2011).
L'impiego della biologia molecolare nell'iter diagnostico preoperatorio al momento ha un valore clinico parziale e le evidenze scientifiche disponibili non supportano con forza il suo impiego routinario. Potrebbe in futuro integrare il report citologico e migliorare sia la selezione dei pazienti da avviare a chirurgia sia "modularne" l'estensione e infine fornire indicazioni circa l'outcome nei pazienti con carcinoma della tiroide ma sono necessari ulteriori studi prospettici multicentlici prima di validarne l'impiego (Baldini E, 2013; Pacini F, 2012).
In particolare, è in corso uno studio clinico (NCT02352766) multicentrico il cui obiettivo è valutare se l'impiego delle nuove tecnologie di analisi del genoma (next-generation sequencing o NGS) con un pannello di analisi mirato per i carcinomi differenziati (ThyroSeq) applicato all'FNA possa essere di aiuto in una migliore stratificazione del rischio neoplastico dei noduli tiroidei, applicato alle categorie 111-IV e V (classificazione di Bethesda, vedi Tabella 2).
RUOLO DELLA “GALECTINA-3-TIREOTEST” NELLA DIAGNOSTICA CITOLOGICA DELLE NEOPLASIE TIROIDEE
Le galectine svolgono un ruolo rilevante nei processi di sviluppo e di crescita embrionale, nella mediazione delle risposte immunologiche e nella regolazione dei processi apoptotici.
Esse, analogamente alle molecole d’adesione, intervengono nel regolare interazioni tra cellula e cellula, e con la matrice.
La galectina-3 è una proteina appartenente alla famiglia delle lectine ed, al pari di queste, è dotata di capacità di legare, con elevata affinità, i residui carboidratici: il suo peso molecolare è di circa 31 kDa ed è composta da due domini, uno dislocato all’estremità carbossi-terminale, contenente la sequenza in grado di riconoscere il residuo carboidratico, ed un altro localizzato all’estremità amino-terminale, strutturalmente simile alle ribonucleoproteine.
L’espressione della galectina-3 è rilevabile sia nel citoplasma che nel nucleo, ed in particolare nel nucleoplasma, ove è coinvolta nei processi di espressione dell’mRNA.
La sua espressione è modulata dallo stato di proliferazione della cellula e dalla sua fase del ciclo cellulare; in particolare è stato rilevato che la galectina-3 è molto espressa nelle cellule attivamente proliferanti, mentre risulta assente in quelle in fase di quiescenza.
Oltre alla sua elevata espressione, correlata allo stato proliferativo delle cellule, la galectina-3 è anche molto espressa nelle cellule trasformate in coltura, e particolarmente in quelle a più elevato potenziale metastatizzante, suggerendo un suo possibile ruolo quale marker di proliferazione maligna.
Di particolare interesse, al fine della caratterizzazione biostrutturale dei noduli tiroidei con connotazioni morfostrutturali di tipo “proliferazione follicolare”, appare la recente utilizzazione di queste in analisi immunocitochimiche che consentono di individuare, in fase preoperatoria, la presenza o meno di lesioni tireocitiche neoplastiche.
Va sottolineato che la galectina-3 non è di solito espressa nel citoplasma delle normali cellule follicolari tiroidee.
L’accumulo citoplasmatico di questa molecola avviene solo dopo trasformazione maligna delle cellule, con conseguente innesco del blocco dell’apoptosi, ovvero del processo di morte cellulare programmata.
Queste recenti acquisizioni hanno consentito di ideare e realizzare un test diagnostico, denominato “galectina-3 tireotest”, applicabile sia su materiale citologico, ottenuto per ago-aspirazione (blocchi cellulari fissati in formalina ed inclusi in paraffina), e applicabile anche su campione istologico.
Tale metodologia immunocitochimica consente di identificare, con elevata accuratezza diagnostica, sia la presenza di nidi isolati di tireociti trasformati, che franche lesioni neoplastiche maligne.
Il test è incentrato sulla capacità di legame di un anticorpo anti-galectina-3 purificato, con la molecola eventualmente presente all’interno delle cellule.
Sul piano metodologico è importante sottolineare che il test deve essere eseguito in un sistema rigorosamente privo di biotina, e può essere visualizzato con il metodo della immunoperossidasi diretta o indiretta.
Il tireotest per la galectina-3 ha già ottenuto una validazione internazionale quale metodica diagnostica preoperatoria del carcinoma tiroideo, ed è attualmente in fase di trasferimento routinario nella pratica clinica di un protocollo di analisi con reagenti standardizzati di nuova generazione.
L’applicazione clinica del test della galectina-3 ha consentito d’acquisire numerosi rilievi, estrapolati da vaste casistiche che, concordemente, indicano come l’espressione proteica della galectina-3 sia notevolmente aumentata (fino a 20 volte) in tutti i tumori tiroidei maligni, ma elettivamente in quelli tiroidei di tipo papillare.
Oltre alla galectina-3, altre molecole sono state saggiate quale ipotetici marker di malignità annidata in lesioni citologicamente non definibili; tra queste menzioniamo la High Mobility Group E-1 (HBME-1), la cheratina-19, la fibronectina-1, etc.
A tutt’oggi, nelle nostre mani, pur non escludendo la possibilità di poter utilizzare in casi selezionati alcuni di questi reagenti in combinazione, nessuna di queste molecole, o combinazione di molecole, sembra offrire elementi più selettivi di quelli forniti dal tireotest alla galectina-3.
Approcci molecolari diretti ad identificare specifici profili genici, e conseguenzialmente proteomici, nelle neoplasie maligne tiroidee, sono stati estesamente riportati in letteratura.
Diversi dati sperimentali, molti dei quali derivanti da analisi di carcinomi papillari tiroidei, mostrano un ben definibile pattern di over-espressione genica, associata con questo istotipo neoplastico.
Tra i geni iperespressi figurano GALS3L (galectina-3), FN1 (fibronectina-1), KRT19 (citocheratina-19) ed il gene MET (proteina c-met correlata).
- TORNA SU -